| [19] Mate | 2010-10-05 18:04:16 |
 Szia!
Párolgási entalpia alatt durván azt a hőt értik, amit a vízzel kell közölni, hogy elpárologjon. A hőtan első főtétele értelmében (Q=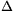 U+W) ez a hő két dologra fordítódik: a belső energia növekedésére ( U+W) ez a hő két dologra fordítódik: a belső energia növekedésére (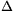 U) és a víz gőzzé alakulása közben a vízgőz által végzett munkára (W). Mivel W=p0 U) és a víz gőzzé alakulása közben a vízgőz által végzett munkára (W). Mivel W=p0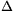 V, ahol a víz V, ahol a víz 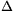 V térfogatváltozása jó közelítéssel egyenlő a keletkezett vízgőz térfogatával, ez pedig nRT/p0, így a tágulási munka nRT, azaz mólonként RT=8,314*298 J/mol V térfogatváltozása jó közelítéssel egyenlő a keletkezett vízgőz térfogatával, ez pedig nRT/p0, így a tágulási munka nRT, azaz mólonként RT=8,314*298 J/mol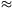 2,48 kJ/mol. A belső energia növekedését tehát úgy kapod, hogy a 44 kJ/mol-ból kivonod a 2,48 kJ/mol-t. 2,48 kJ/mol. A belső energia növekedését tehát úgy kapod, hogy a 44 kJ/mol-ból kivonod a 2,48 kJ/mol-t.
Remélem érthető volt.
|
| Előzmény: [18] kocsmavirág, 2010-05-19 16:56:55 |
|
| [18] kocsmavirág | 2010-05-19 16:56:55 |
 Sziasztok mesterek.
Én még nem régóta tanulok termodinamikát az iskolában és sajnos vannak feladatok amik fejtörést okoznak. Pl. A víz párolgási entalpiája 298 K-en 44kj/mol.Számítsa ki DeltaU-értékét. A feladatgyűjtemény 41,52kj/mol-t jelől meg megoldásnak. Én nem értem,hogy ez,hogyan jön ki. Mert ha 298 k-en 44kj/mol energiát kell befektetni,hogy 1 mol víz elpárologjon akkor a belső energiája is enyivel kellene ,hogy nőjön. Vagy nem?
Aki segít annak köszönöm.
|
|
|
|
| [15] m2mm | 2009-11-23 22:36:28 |
 Szerintem:Feltehetőleg egyenletesen engedjük ki a gázt. Általános gáztörvény: pV=nRT. Tudjuk, hogy a térfogat állandó. Tehát  . n=m/M, valamint 1.69 mg gázt engedünk ki:n1M=m1, m1-1.69mg=m2, n1M=n2M+1.69mg n1-et kiszámítod az általános gáztörvényből: . n=m/M, valamint 1.69 mg gázt engedünk ki:n1M=m1, m1-1.69mg=m2, n1M=n2M+1.69mg n1-et kiszámítod az általános gáztörvényből:  , ezek adottak. Magyarán kapsz egy egyenletet, ahol egy ismeretlen van:p2, ami a kérdés. A hőmérsékletet kelvinben számold, a megfelelő mennyiségeket a megfelelő mértékegységgel: a nyomást Pa-ban, a n-et molban, M-et g/molban, m-et g-ban.R az egyetemes gázállandó (8,314 J/mol*K). Miután átváltva kiszámítod p2-t, akkor tehát Pa-ban kapod meg, azt átváltod MPa-ra. , ezek adottak. Magyarán kapsz egy egyenletet, ahol egy ismeretlen van:p2, ami a kérdés. A hőmérsékletet kelvinben számold, a megfelelő mennyiségeket a megfelelő mértékegységgel: a nyomást Pa-ban, a n-et molban, M-et g/molban, m-et g-ban.R az egyetemes gázállandó (8,314 J/mol*K). Miután átváltva kiszámítod p2-t, akkor tehát Pa-ban kapod meg, azt átváltod MPa-ra.
|
| Előzmény: [12] Erdei Oszkár, 2009-11-23 08:41:31 |
|
|
|
| [12] Erdei Oszkár | 2009-11-23 08:41:31 |
 Van valakinek valami ötlete, hogy ezzel mit lehet csinálni?
Egy 7.8 cm3-es tartályban 205 kPa nyomású nitrogén (M=28g/mol) gáz van. A kezdetben 78 fok C-os gáz hőmérsékletét 265 K-re változtatjuk. A folyamat közben 1.69 mg gázt is kiengedünk . Mekkora lesz a gáz nyomása MPa-ban?
|
| Előzmény: [11] Erdei Oszkár, 2009-11-22 16:28:54 |
|
|
| [10] HoA | 2009-11-22 16:24:03 |
 Nem tudom manapság hogy van, de a mi időnkben a középiskolában volt függvénytáblázat, és azt még a 2-es matekosok is tudták ( bocs, ha ezzel valakit megbántok ) hogy hogyan kell egy szög szögfüggvényét, illetve a függvényértékből a szöget visszakeresni. Manapság talán egy excel tábla függvényei a legismertebbek erre a feladatra.
|
| Előzmény: [9] Erdei Oszkár, 2009-11-22 16:09:31 |
|
|
| [8] jonas | 2009-11-22 15:54:00 |
 Hogyan kapod meg általában egy szög szinuszát? (Persze a 30° egyszerűbb.) Ha például függvénytáblázatból keresed ki, akkor ugyanabban a táblázatban fordítva is lehet keresni. Ha számítógéppel számolod ki, az a szinusz függvény inverzét is ki tudja számolni.
|
| Előzmény: [6] Erdei Oszkár, 2009-11-22 15:42:35 |
|
|
| [6] Erdei Oszkár | 2009-11-22 15:42:35 |
 Köszi!!!!!!!!!!!! Ez zseniális szóval akkor Én az alfa szög szinuszát kapom meg, de szinuszból meg honnan tudom, hogy mennyi a fokok száma:(( (bár lehet, hogy ezt tudnom kéne?!)
|
| Előzmény: [4] Erdei Oszkár, 2009-11-22 13:33:33 |
|
|
| [4] Erdei Oszkár | 2009-11-22 13:33:33 |
 Kedves Bohner Géza! Biológus hallgató vagyok és komoly gondjaim vannak a fizivel egászpontosan a kinematikával gáztörvényekkel és mostmár az optikával is. Nem értem, hogy a gyakorlaton ha adva volt (fénytörésről van szó) a B - a szög és a törésmutató amelyek rendre 30 fok és 1,45 akkor sin a/sin30 = 1.45 - ből, hogy a mendörgösmenkübe lett 46,47 fok az alfa. Várom válaszát!
|
| Előzmény: [2] BohnerGéza, 2009-09-12 21:06:48 |
|
| [3] BohnerGéza | 2009-09-12 21:16:14 |
 Tényleg bocs! Elfelejtettem:
http://hu.wikipedia.org/wiki/Hőkapacitás
Arra gondolok, ha nem levegőről, hanem gázkeverékről van szó, akkor pl. a hidrogéntartalmúé igen nagy lehet.
|
| Előzmény: [2] BohnerGéza, 2009-09-12 21:06:48 |
|
|
| [1] MateMSR | 2009-09-12 16:32:31 |
 Sziasztok!
Adott egy termodinamikai feladat melyben egy levegökevereknek kell a hömersekletet kiszamolni. Ehhez ugye kell a levegö hökapacitasa, ami 20C körulbelul 1 J/(mol·K). Ehhez kepest a feladatkeszitök ennek a duplajaval, 5/2 J/(mol·K) szamolnak. Ez az ertek azonban szamomra tul pontos, hogy egy tablazati ertek legyen. Kinek van igaza, es ha megis az utobbi, akkor mert pont 5/2?
|
|
